Het onderzoek naar het gebruik van stamcellen als geneesmiddel zit in de lift. Maar concrete toepassingen stuiten geregeld op onverwachte obstakels.
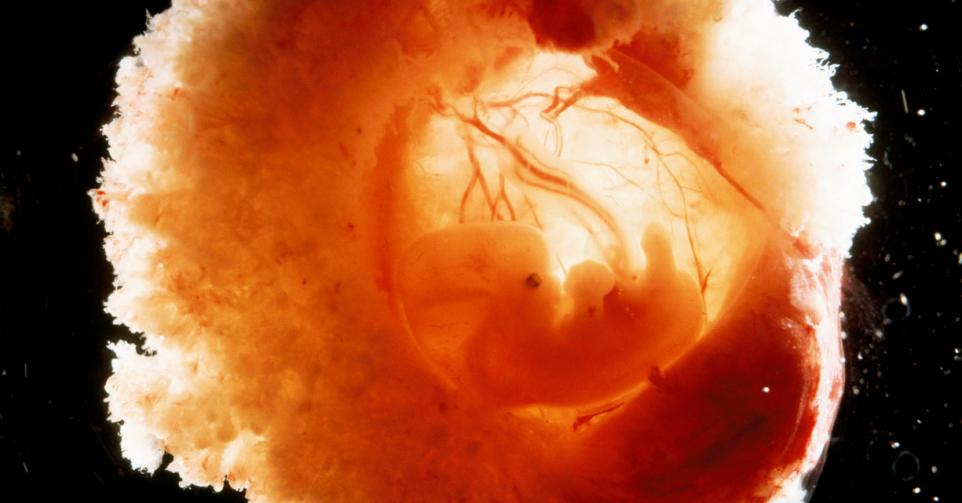
In oktober 2023 publiceerde moleculair bioloog Vincent Pasque (KU Leuven) met een aantal collega’s in het vakblad Nature een baanbrekend artikel, waarin ze aantoonden dat ze goed op weg zijn om met stamcellen een min of meer volwaardig menselijk embryo van zo’n twee weken oud te maken.
Stamcellen kunnen beschouwd worden als oerlichaamscellen: met de juiste signalen kunnen ze uitgroeien tot eender welke andere lichaamscel. Ons lichaam zit barstensvol stamcellen. Ze maken nieuw bloed als dat nodig is, of nieuwe haarcellen, nieuwe levercellen enzovoort. Ook andere dieren én planten steunen voor hun ontwikkeling en herstel op stamcellen.
Het was al relatief snel na de ontdekking van hun mogelijkheden duidelijk dat stamcellen een rol in de geneeskunde zouden kunnen spelen – aanvankelijk werd zelfs enthousiast van een ‘Heilige Graal’ gesproken. Een belangrijke hinderpaal was dat ze voor menselijk onderzoek uit mensenembryo’s gehaald moesten worden. Maar dat ethische bezwaar werd omzeild toen in 2006 ontdekt werd hoe volwassen lichaamscellen ‘geherprogrammeerd’ kunnen worden tot oerstamcellen die zelf opnieuw kunnen uitgroeien tot eender welke andere cel. Ze krijgen als het ware een verjongingskuur.
De ontdekking werd in 2012 bekroond met de Nobelprijs voor Geneeskunde. Ze maakte het mogelijk om stamcellen te verkrijgen zonder dat er embryo’s voor hoefden te worden opgeofferd.
Embryonale ontwikkeling
Sinds kort wordt zelfs de omgekeerde weg gevolgd: embryo’s maken met stamcellen. Er wordt hard gewerkt aan methodes om de embryonale ontwikkeling te kunnen onderzoeken zonder echte embryo’s. Om praktische én ethische redenen kunnen onderzoekers beginnende menselijke embryo’s, bijvoorbeeld ‘overschotjes’ van vruchtbaarheidsbehandelingen, niet langer dan twee weken laten groeien.
Onderzoek van oudere embryo’s was vroeger in principe alleen mogelijk op ‘materiaal’ van abortussen, wat de opties in grote mate beperkte.
De creatie van menselijke embryo’s uit stamcellen moet die obstakels omzeilen. Alvast in de experimenten van Pasque en zijn collega’s bleken de gebruikte stamcellen zich zo te organiseren dat ze een structuur vormen, die gelijkenissen vertoont met die van een mensenembryo van een tweetal weken. Ze zouden zich in principe in de baarmoederwand kunnen hechten voor verdere ontwikkeling. De namaakembryo’s bleken voorlopers van bloedcellen te vormen, en zelfs van zaad- en eicellen.
Stamcellen kunnen hart vormen
In een vrij recent overzichtsartikel in Cell Stem Cell argumenteren Pasque en een collega dat het niet correct is om het resultaat van hun werk als ‘synthetische embryo’s’ te labelen, zoals her en der weleens gebeurt. Om te beginnen is er niks synthetisch aan, want de ontwikkeling volgt gewoon klassieke biologische paden, alleen in een laboratoriumschaaltje en niet in een lichaam. Het nabootsen ervan vergt onder meer het zoeken naar de juiste biologische signalen voor de differentiatie van de cellen in andere celtypes, en naar het meest geschikte groeimedium voor het structuurtje.
Experimenteel systeem
Bovendien – en dat is belangrijk voor de ethische discussies – zijn het in feite geen echte embryo’s, want ze bieden ‘geen perfecte recapitulatie van de samenstelling van celtypes, hun onderlinge verhoudingen en hun ruimtelijke organisatie’ van wat in de natuur gebeurt. Ze zijn niet meer, maar ook niet minder, dan ‘een aantrekkelijk experimenteel systeem met veel voordelen en mogelijkheden’.
Een analyse van het werk met stamcelembryo’s in een commentaarstuk in Nature legde een aantal pijnpunten bloot. De cellen blijken zich ook niet altijd op dezelfde manier te ordenen, wat toepassing bemoeilijkt.
Niet onbelangrijk is dat deze ‘embryo’s’ de eerste fasen van hun natuurlijke ontwikkeling vanaf de geboorte overslaan. Het is niet bekend wat daar het effect van kan zijn.
‘Het zou nu al wetenschappelijk mogelijk zijn de stamcelembryo’s te laten doorgroeien tot ze een kloppend hart hebben.
Finaal is er de vraag of de maatschappij wel klaar is voor een verdere ontwikkeling van dit type embryo’s. Het zou nu al wetenschappelijk mogelijk zijn ze te laten doorgroeien tot ze een kloppend hart hebben en een ruggenmerg, na een kleine maand in hun ontwikkeling.
Maar het is niet omdat iets wetenschappelijk kan, dat het ook moet worden doorgeduwd, stelde een analist in Nature. Zeker omdat stamcelmodellen van embryo’s buiten de bestaande regelgeving rond embryo-onderzoek vallen. Er wordt dus aangemaand tot voorzichtigheid.
Parkinson
Ook wat het gebruik van stamcellen in de geneeskunde betreft, zo bleek uit recente overzichtsartikelen in Nature en Science, is er niet altijd een maatschappelijke consensus. Stamcellen kunnen worden ingezet voor de behandeling van aandoeningen als blindheid, verlamming, hartfalen, beroerte, epilepsie en de ziekte van Parkinson. Die laatste treft steeds meer mensen, mede als gevolg van frequente blootstelling aan schadelijke pesticiden.
In Nature verschenen onlangs artikels die doorbraken beschreven in het onderzoek van het gebruik van stamcellen voor de behandeling van de ziekte van Parkinson. Critici oordeelden al dat het niet om echte genezing gaat, maar om het remediëren van symptomen zoals de ongecontroleerde bevingen die met de ziekte gepaard gaan – ook de klassieke geneeskunde kan hier alleen symptomen bestrijden.
De studies beschreven ook niet meer dan de eerste fase van het klinisch onderzoek op patiënten, die moet aantonen dat middelen veilig zijn voor gebruik. Dat blijkt het geval te zijn.
Er zijn ook al indicaties dat ze nuttig zijn – anders heeft het niet veel zin er geld en energie in te pompen. Een van de zeven proefpersonen kon voor het eerst sinds lang zelfs tijdelijk zonder assistentie functioneren. De behandeling bestond uit het in de hersenen spuiten van 5 à 10 miljoen stamcellen, die zo waren voorgeprogrammeerd dat ze konden uitgroeien tot volwaardige hersencellen. De resultaten worden veelbelovend genoemd.
Lamme kan weer lopen
Hetzelfde geldt voor trials voor de behandeling van verlamming als gevolg van een gebroken ruggengraat. Drie maanden geleden werden de eerste resultaten voorgesteld – op een persconferentie, niet in een vakblad. Van vier verlamde personen was er één na behandeling in staat om weer te lopen. Een tweede kon opnieuw armen en benen bewegen. Twee anderen zagen echter geen verbetering van hun situatie.
Iets vergelijkbaars gaat op voor de behandeling van blindheid door het regenereren met stamcellen van een deel van het netvlies of het hoornvlies. Enkele proefpersonen zagen een verbetering van hun situatie, andere niet. Waaraan de verschillen in succes te wijten zijn, is onduidelijk. Obstakel is zeker het feit dat vooral het netvlies niet echt over een natuurlijke capaciteit tot zelfherstel beschikt.
Toch groeit de euforie. Wereldwijd lopen er zo’n zestig klinische proeven met het medisch gebruik van stamcellen – een derde ervan in Japan, voortrekker in dit onderzoek. In Japan wordt er druk gelobbyd om de gebruikelijke trage weg van ontwikkeling van een geneesmiddel voor stamcelprocedures te vervangen door iets snellers, met als voornaamste argument dat het anders veel te lang zou duren voor patiënten van een nieuwe baanbrekende behandeling kunnen profiteren.
In Japan wordt er druk gelobbyd om de gebruikelijke trage weg van ontwikkeling van een geneesmiddel voor stamcelprocedures te vervangen door iets snellers.
Een argument dat courant in het debat wordt gegooid, is dat een versnelde ontwikkeling een ‘vorm van risico’ mag impliceren. ‘Conventionele regulatie’ zou namelijk innovatie remmen. Concreet zou het betekenen dat genezende procedures op de markt zouden komen vóór de derde fase van de klinische tests – het gecontroleerd gebruik door een groot aantal patiënten – is afgerond. De evaluatie gebeurt dan deels ‘en route’.
Hartspier bijspijkeren
Maar er groeit weerstand tegen de vooruitsnellende visie, zeker omdat twee programma’s, voor respectievelijk het bijspijkeren van de hartspier en het oplossen van klonters in bloedvaten, moesten worden stopgezet omdat er geen noemenswaardig voordeel voor de patiënten was.
Bovendien is een behandeling peperduur – zo’n 60.000 euro per sessie. De voorgestelde Japanse shortcut zou er wel toe kunnen leiden dat farmaceutische bedrijven niet langer zelf hoeven in te staan voor de financiering van trials, maar dat het deels op kosten van de overheid, verzekeringsinstanties of misschien wel patiënten zelf zou gebeuren – in het laatste geval krijg je uiteraard een klassengeneeskunde, waarin alleen rijkeren een behandeling kunnen betalen.
Daarenboven zet de industrie volop in op het gebruik van donorstamcellen – van iemand anders dan de patiënt zelf – wat de kostprijs beperkt, maar de kans op succes hypothekeert. Donorstamcellen dreigen als lichaamsvreemde cellen gemakkelijker afgestoten te worden dan hergeprogrammeerde stamcellen uit het eigen lichaam, maar de laatste procedure is een stuk duurder.
Volgens Nature zijn er van de bijna zevenhonderd patiënten wereldwijd die tot dusver een stamcelbehandeling kregen, slechts elf die behandeld werden met eigen stamcellen – te weinig om iets over eventuele significante verschillen te kunnen zeggen.
Het blad pleit dan ook voor ‘voorzichtigheid en terughoudendheid’ in de aanpak, zeker om een backlash in de publieke opinie over stamcelbehandelingen te vermijden mocht blijken dat er toch ernstige problemen opduiken. Wetenschappelijk enthousiasme vertaalt zich niet automatisch in maatschappelijke goedkeuring.
Fake traanklieren
Nog een domein waarin stamcellen een betekenisvolle rol kunnen spelen, is een variant op het embryo-onderzoek: de creatie van orgaantjes in laboratoriumschaaltjes voor nader onderzoek. Het wordt zelfs niet uitgesloten dat er met stamcellen ooit nieuwe organen voor transplantatie zullen worden gemaakt, wat een zegen zou zijn, gezien het chronisch tekort aan donororganen voor transplantatie.
Een tijdje geleden publiceerden Nederlandse onderzoekers in Cell Stem Cell bevindingen rond het namaken van traankliertjes in het lab, zodat ze problemen met de traanproductie gemakkelijker kunnen onderzoeken. De namaakkliertjes konden zelfs huilen.
Hoe artificieel gekweekt bloed in de toekomst mensenlevens kan redden
Maar ook dat soort ontwikkelingen loopt niet noodzakelijk van een leien dakje. Neurobioloog Pierre Vanderhaeghen (VIB/KU Leuven) werkte mee aan een recent overzichtsartikel in Nature van een ruime schare experts uit de hele wereld, die procedures voorstellen voor het stroomlijnen van het werk.
Menselijke stamcellen blijken in laboratoriumculturen ook gemakkelijker te muteren dan in een lichaam, wat impliceert dat er na toediening een verhoogd risico op bijvoorbeeld de ontwikkeling van kanker zou kunnen zijn.
Een verschil in kwaliteit van de in experimenten gebruikte stamcellen kan al significante verschillen in resultaten opleveren. Door hun plasticiteit doen de cellen ook niet altijd wat de wetenschappers hopen dat ze zullen doen.
Menselijke stamcellen blijken in laboratoriumculturen ook gemakkelijker te muteren dan in een lichaam, wat impliceert dat er na toediening een verhoogd risico op bijvoorbeeld de ontwikkeling van kanker zou kunnen zijn. Er moet eveneens rekening gehouden worden met mogelijke verschillen tussen mannen en vrouwen.
Het overzichtsartikel waarschuwt ervoor dat het nooit voor de hand zal liggen om een bruikbare brug te slaan tussen de resultaten van experimenten met modellen van organen en ziektes én de harde realiteit van de complexe geneeskunde met patiënten die allemaal van elkaar verschillen. Ook daarom is voorzichtigheid geboden.