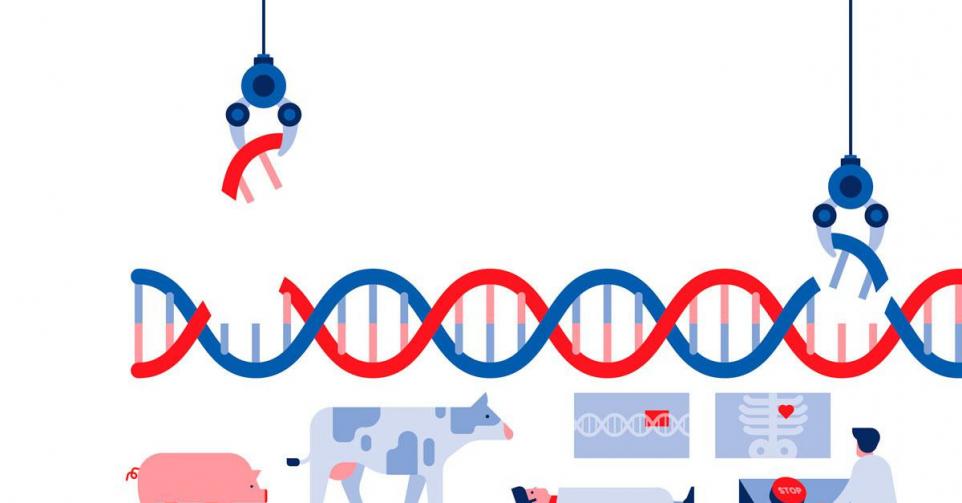
Gentherapie met Crispr-Cas9: kan genetisch knip-en-plakwerk de wereld veranderen?

De ontdekking van genetisch knip-en-plakwerk door middel van de Nobelprijswinnende Crispr-Cas9-technologie moet leiden tot doorbraken in de geneeskunde én in een milieuvriendelijker landbouw.
Het klinkt bijna te mooi om waar te zijn, en het is ook nog niet waar. Maar de wetenschap lijkt wel op weg om het waar te maken. Een verslag in Science Translational Medicine beschrijft de eerste resultaten rond doeltreffende pijnbestrijding met de nieuwe techniek ‘Crispr-Cas9’. Met die methode kunnen genetische mankementen doelgericht worden aangepakt. In het geval van het beschreven experiment ging het om het lamleggen van natriumcommunicatiekanalen in de membraan van zenuwcellen, waardoor pijnprikkels niet langer worden doorgegeven. Zo moet chronische pijn verholpen kunnen worden.
De aanpak heeft veel potentieel, want volgens sommige studies krijgt tot de helft van de Europeanen en Amerikanen te kampen met chronische pijn. De klassieke behandeling steunt op pijnstillers zoals morfine en andere zogenaamde opioïden, maar zoals de naam suggereert zijn die verslavend – vooral in de Verenigde Staten sterven veel mensen aan overmatig gebruik van verslavende pijnstillers.
Gewone medische moleculen kunnen niet worden ingezet om de betrokken natriumkanalen te remmen, want de kanaaltjes spelen op veel plekken in het lichaam een belangrijke rol, zodat een onzorgvuldige ingreep tot een cascade van neveneffecten kan leiden. Maar in de eerste proeven met Crispr-Cas9 kon de behandeling precies mikken op de plekken waar ze nodig is om de pijn te bestrijden. Het ging om tests met proefdieren, maar wetenschappers puren moed uit het feit dat ze muizen tot 44 weken lang pijnvrij konden maken – voor een muis is dat héél lang. Het voedt de hoop dat er een bruikbare therapie voor de mens uit zal voortvloeien.
Nobelprijs
De crispr-techniek werd amper acht jaar geleden beschreven, maar hij leverde zijn ontdekkers vorig jaar al de Nobelprijs voor de Scheikunde op – naar Nobelprijsnormen is dat héél snel. Voor het eerst ging een Nobelprijs naar twee vrouwen: de Amerikaanse Jennifer Doudna en de Française Emmanuelle Charpentier. De mannen die in aanmerking kwamen om mee in de prijs te delen (een Nobelprijs wordt nooit aan meer dan drie mensen tegelijk toegekend) legden zich publiekelijk neer bij het verdict: de ‘ontdekking’ kwam van deze vrouwen, zij deden ‘uitvindingen’ om de ontdekking in de praktijk te brengen.
Ook een oogziekte kon met Crispr-Cas9 behandeld worden: de genetische fout werd gewoon weggesneden.
De ontdekking steunde op basisonderzoek van microben. Die hebben soms lange stukken DNA in hun genoom dat afkomstig is van virussen. Ze fungeren als herinnering aan vroegere infecties voor hun afweer. Op 28 juni 2012 beschreven de twee vrouwen met hun teams in Science hoe crispr-DNA gebruikt kan worden om ander DNA ‘bij te sturen’. Als je er een soort gids-RNA aan toevoegt, kun je het naar specifieke genen op specifieke plekken in het lichaam mikken.
Cas9 is dan weer een enzym dat als knip- en plaksysteem fungeert, zodat eventuele fouten in genen kunnen worden hersteld. De techniek is vrij gemakkelijk in gebruik, zodat hij geleid heeft tot een wetenschappelijke ‘goudkoorts’. Iedereen is op zoek naar praktische toepassingen – een betrachting die uitgemond is in een oorlog om octrooien en andere toepassingsrechten, onder meer tussen ‘ontdekkers’ en ‘uitvinders’.
Er wordt zowaar gesproken over de genezing van erfelijke aandoeningen en de behandeling van ziektes zoals kanker. Maar ook over een verhoging van de voedselproductiecapaciteit, en het counteren van effecten van de klimaatopwarming. Planten kunnen genetisch gemanipuleerd worden zodat ze meer van het broeikasgas CO2 opslaan dan nu het geval is. Belgische wetenschappers meldden in Nature Communications dat ze populieren met Crispr-Cas9 zo hebben bijgestuurd dat er makkelijker (en klimaatvriendelijker) papier en biobrandstof uit gewonnen kan worden. De ingreep vermindert de productie van het eiwit lignine, dat een belangrijk obstakel is in het verwerken van het hout.
Verder op het lijstje? Gewassen zoals erwten en bonen manipuleren om meer stikstof vast te houden, zodat de teelt minder bemesting nodig heeft en dus minder stikstofvervuiling veroorzaakt. Tomaten behandelen om ze smakelijker te maken en sinaasappelen om ze transportbestendiger te maken. Bananen zouden extra weerstand kunnen krijgen tegen virussen en schimmels die nu een substantieel deel van de oogst vernietigen. Chinese wetenschappers, die voluit inzetten op de technologie, rapporteerden in Cell dat ze een methode klaar hebben om met Crispr-Cas9 het domesticeren van wilde rijstsoorten sneller en efficiënter te maken.
Sommige experimenten doen de wenkbrauwen fronsen. Wetenschappers hebben koeien zo gemanipuleerd dat ze lichtgrijze vlekken ontwikkelen in plaats van zwarte, waardoor ze minder gevoelig zouden zijn voor de hogere temperaturen die ze mee veroorzaken door de grote bijdrage van veeteelt aan de klimaatopwarming. Misschien zou men beter de veestapel afbouwen dan het vee klimaatbestendiger maken. Ook de introductie van genen voor korter haar moet koeien extra weerstand geven tegen hogere temperaturen.
Orgaanfabriekjes
Aan varkens wordt dan weer gesleuteld om er fabriekjes van menselijke organen van te maken. Het blad New Scientist beschreef resultaten van een Chinees biotechbedrijf dat negen menselijke genen toevoegde aan het genoom van varkens, terwijl er tegelijk ‘dozijnen’ varkensgenen werden uitgeschakeld om de kans te verkleinen dat de geproduceerde organen na transplantatie in de mens worden afgestoten door ons afweersysteem. Dat hiervoor naar varkens gekeken wordt, heeft er vooral mee te maken dat de afmetingen van hun organen min of meer overeenstemmen met die van ons.
De eerste concrete resultaten voor medische toepassingen zijn er. In de eerste plaats is er de ontwikkeling van diagnostische tests, onder meer een efficiëntere variant om een besmetting met het coronavirus op te sporen dan de PCR-test die er nu courant voor gebruikt wordt. Ook de strijd tegen parasieten moet kunnen profiteren van de methode. Een voorbeeld verscheen in The Journal of Biological Methods: wetenschappers beschreven een scenario om eencellige parasieten onvruchtbaar te maken, zodat ze op z’n minst plaatselijk zouden uitsterven. De sleutel is het kreupel maken van genen die nodig zijn voor de productie van hun voortplantingscellen.
Ook klinische tests staan in de steigers. Science meldde eind 2019 dat het Zwitserse biotechbedrijf CRISPR Therapeutics, gesticht door onder meer Nobelprijswinnares Charpentier, er als eerste in slaagde patiënten succesvol met de techniek te behandelen. Het ging om mensen met een aangeboren bloedaandoening: sikkelcelanemie en betathalassemie, beide te wijten aan fouten in de productie van de zuurstofoverdrager hemoglobine (die ons bloed rood maakt).
De behandeling bestond uit het genetisch bijsturen van bloedstamcellen, zodat ze een embryonale versie van hemoglobine kunnen produceren. De behandelde cellen werden vervolgens aan de patiënten toegediend. Het gevolg was dat ze minder bloedtransfusies nodig hadden om de gevolgen van hun ziekte op te vangen. Eind 2020 werden de eerste klinische resultaten officieel bekendgemaakt in The New England Journal of Medicine. Ze lijken veelbelovend. Belangrijkste pijnpunt is momenteel de kostprijs van een behandeling, die geraamd wordt op 1,5 miljoen euro per patiënt. Dat heb je met pionierswerk.
Er wordt aan varkens gesleuteld om er fabriekjes van menselijke organen van te maken.
Begin 2020 meldde Science een volgend succesvol experiment: een genetische oogziekte kon met Crispr-Cas9 behandeld worden. Het betrof een aangeboren vorm van blindheid die het resultaat is van een genetische fout in de netvliescellen die licht omzetten in elektrische signalen. Door middel van Crispr-Cas9 kon de fout weggesneden worden, zodat patiënten ineens minstens gedeeltelijk konden zien.
Terminale kanker
Niet alles verloopt even vlot, want niet alle aandoeningen zijn genetisch even eenvoudig. Kanker is een ingewikkelde ziekte, zodat het niet makkelijk is om er een oplossing voor te vinden. Een verslag in Science beschreef het wedervaren van drie (terminale) kankerpatiënten die met Crispr-Cas9 behandeld werden: één van hen stierf vrij snel, bij de twee anderen verergerde de ziekte. Maar het was niet de bedoeling dat ze genazen. Met hun toestemming werd gekeken naar wat de technologie in een lichaam doet. Het werk legde tekortkomingen bloot, zoals het feit dat er af en toe DNA geknipt wordt op plekken waar het niet mag.
Het vakblad Communications Biology bracht een uitweg voor een van de grote problemen: hoe houd je de technologie in een mensenlichaam onder controle? Hoe zorg je ervoor dat je een eventuele ingreep kunt stoppen als hij niet meer nodig is (of als blijkt dat hij niet doet wat ervan verwacht werd, bijvoorbeeld door genetische sequenties te viseren die erg lijken op die waarvoor hij geprogrammeerd is, maar niet de juiste zijn)? In essentie komt het neer op de zoektocht naar een stopknop, een anti-crispr. Echt moeilijk kan dat niet zijn, want virussen hebben op natuurlijke wijze remmers ontwikkeld tegen het crispr-systeem dat bacteriën tegen hen inzetten. Er zijn er al een vijftigtal in kaart gebracht: ze fungeren als de ‘steen’ in het spelletje met ‘de schaar’.
Veiligheidshalve voltrekt het meeste medisch onderzoek zich voorlopig op het niveau van proefdieren. Nature rapporteerde succes bij de behandeling van een muizenversie van progeria, de ziekte die maakt dat jonge mensen héél snel verouderen als gevolg van genetische fouten. New Scientist beschreef experimenten om bij muizen gewone vetcellen om te bouwen tot beige vetcellen, die veel geschikter zijn om energie te produceren, waardoor ze nuttig zouden kunnen zijn in het bestrijden van stofwisselingsstoornissen, zoals obesitas.
Er wordt ook geëxperimenteerd met culturen van menselijke cellen in laboratoriumschaaltjes. Zo zijn menselijke hersencellen in celculturen zo bijgestuurd dat ze minder gevoelig worden voor de productie van het beta-amyloïdeiwit dat een sleutelrol speelt in de ontwikkeling van de ziekte van Alzheimer. De hoop is dat de maatschappelijke overlast van alzheimer en andere dementieprocessen er ooit mee kan worden verlicht.
Prutsen aan hersencellen is natuurlijk van een ander kaliber dan het wegwerken van een bekende genetische fout in oog- of bloedcellen. Toch houdt het onderzoekers niet tegen om zich eraan te wagen. Zo kondigde Science aan dat wetenschappers erin geslaagd zijn minihersentjes in laboratoriumomstandigheden (zogenaamde organoïden) te maken. De elektrische activiteit in de minihersentjes is vergelijkbaar met wat er in gewone hersenen gebeurt.
Vervolgens brachten de onderzoekers door middel van Crispr-Cas9 een bij ons verloren gegane genvariant uit het genoom van neanderthalers in de hersencelculturen in. Het gevolg waren orgaantjes die kleiner en anders van structuur waren dan die gebaseerd op ‘pure’ cellen van de moderne mens. Dat is spelen met de mogelijkheden van de technologie om er tegelijk zowel intrigerende wetenschap als inzicht in toepassingen uit te puren, zonder dat er proefdieren ingeschakeld hoeven te worden – wat altijd een pluspunt is.
Doofheid
De ultieme droom van sommige wetenschappers is het permanent bijsturen van het menselijke genoom, zodat er achteraf niet voortdurend bij individuele patiënten correcties hoeven te worden gemaakt. Maar dat streven stuit vooralsnog op grote weerstand. Het onfortuinlijke experiment van de Chinese arts He Jiankui, die zeven koppels zo ver kreeg dat ze door middel van Crispr-Cas9 een baby zouden laten ‘maken’ die nooit besmet zou kunnen raken met het aidsvirus, leidde wereldwijd tot grote opschudding – het plan resulteerde in de geboorte van drie baby’s, waaronder een tweeling. China, dat technologisch nochtans vooruitstrevend is en zich minder gelegen laat aan ethische beslommeringen, gooide de man in 2019 zelfs in de gevangenis.
De Russische bioloog Denis Rebrikov heeft plannen om de embryo’s van vijf koppels waarvan beide ouders genetisch doof zijn, door middel van Crispr-Cas9 zo te behandelen dat de kinderen niet doof geboren worden. Daarvoor wil hij de kiemcellen (de allereerste embryonale cellen) behandelen, zodat alle cellen de bijsturing dragen. Ze zal ook met de geslachtscellen worden doorgegeven aan de volgende generaties. Als je een beginnend embryo in een laboratoriumschaaltje met de techniek bewerkt en daarna in de moeder inbrengt, kun je het definitief ‘genezen’ van een afwijking. ‘De verleiding om te knutselen met kiemcellen zal niet weggaan’, schreef Nobelprijswinnares Jennifer Doudna in Science. De Russische wetenschapper wil wel wachten tot hij toestemming heeft voor hij eraan begint, maar hij stuit internationaal op (voorspelbare) weerstand, al was het maar omdat sommigen doofheid niet als een levensbedreigende aandoening beschouwen, waardoor de ingreep niet ‘essentieel’ wordt gevonden.
Ondertussen denken sommige wetenschappers al aan een vervangtechniek voor Crispr-Cas9, nog voor dat goed en wel op de markt is. De Crispr-methode zou toch wat te veel nadelen bevatten voor algemeen gebruik. Volgens Nature zou een waardige opvolger dezelfde RNA-techniek zijn die aan de basis ligt van de fameuze mRNA-vaccins die vandaag onze eerste verdediging tegen het coronavirus vormen. Je kunt er boodschappermoleculen mee maken die fouten in genen opvangen door hun inhoud niet rechtstreeks te vertalen, maar wel in de correcte versie van het eiwit dat de betrokken genen moeten produceren. Het is eigen aan wetenschappelijk onderzoek: er duikt altijd wel iets nieuws op om te exploreren.
Fout opgemerkt of meer nieuws? Meld het hier