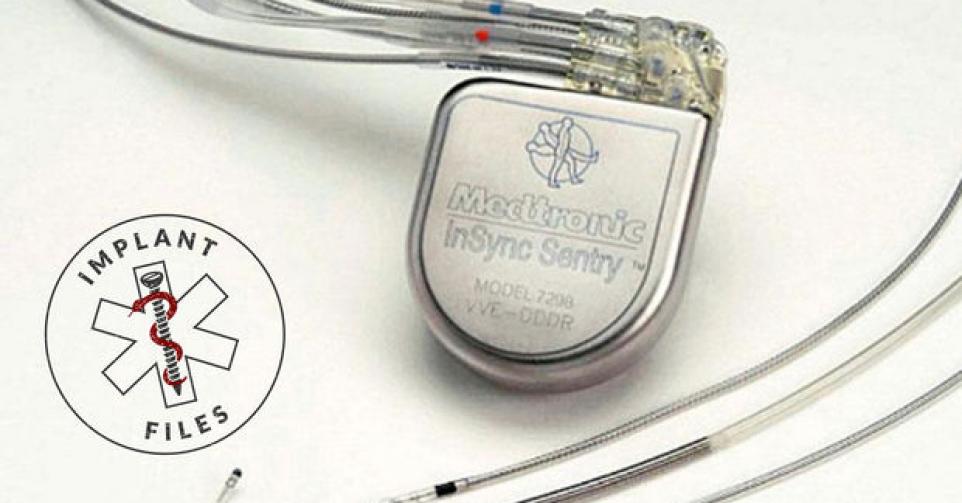
Sprint Fidelis, de geleidingsdraad die brak bij hartpatiënten

De geleidingsdraad mocht op de markt komen zonder dat hij ooit op mensen was getest.
Zelfs jaren nadat een implantaat van de markt is gehaald, blijven er nog incidenten opduiken bij patiënten die het ooit in hun lijf kregen. Zo liepen dit jaar bij het Federaal Agentschap voor Geneesmiddelen en Gezondheidsproducten (FAGG) nog zes incidentenrapporten binnen over de Sprint Fidelis. Dat is een draad die het hart verbindt met een defibrillator, ingeplant bij mensen die risico lopen op een hartstilstand. De draad zorgt ervoor dat het implantaat informatie over het hartritme kan registreren. Al in 2007 stopte fabrikant Medtronic met de verkoop van Sprint Fidelis. Er was een te hoog risico dat de draad zou breken. Wereldwijd waren toen al 268.000 van die geleidingsdraden geïmplanteerd, vooral in de VS. De fabrikant raadde af om de geleider nog te implanteren. Maar de reeds geïmplanteerde geleiders preventief vervangen, bleek ook niet wenselijk. De geleidingsdraad mocht op de markt komen zonder dat hij ooit op mensen was getest.
Een ICIJ-onderzoek van de incidentrapporten uit de FDA-databank toont dat Medtronic en andere rapporteurs van incidenten de Sprint Fidelis-modellen in het voorbije decennium linkten aan meer dan 8000 verwondingen en 2000 overlijdens. Case by case moet het causale verband dan worden bekeken. Door de jaren heen hebben patiënten in verschillende landen geklaagd dat ze nooit correct waren geïnformeerd over de risico’s.
Fabrikant Medtronic antwoordde niet op specifieke vragen van het ICIJ over Sprint Fidelis. Medtronic houdt wel vol dat het een implantaat pas op de markt brengt ‘als we bevestiging hebben dat het veilig en effectief is. En ook nadat het op de markt is, blijven we de veiligheid en de werking opvolgen.’

ICIJ bouwt eigen implantatendatabank
Een interessante vaststelling in de Implant Files is dat geneesmiddelenagentschappen wereldwijd soms heel verschillende veiligheidsberichten over implantaten publiceren. Over een implantaat dat in het ene land wordt ‘gerecalled’, hoor je in het andere land soms helemaal niets. Om dat probleem te verhelpen, bouwde het ICIJ dan maar zelf een publieke en doorzoekbare databank: de International Medical Device Database. Daarin staat momenteel informatie over meer dan 70.000 veiligheidswaarschuwingen uit 11 landen. De komende weken en maanden breidt het ICIJ de databank nog verder uit met bijkomende gegevens.
Een andere implantatendatabank laat in België al jaren op zich wachten. In 2010 brak het schandaal rond de zogenaamde PIP-implantaten los, vernoemd naar de Franse firma Poly Implant Prothèse. Die produceerde borstimplantaten gevuld met een siliconengel die niet was goedgekeurd. Doordat siliconen niet geschikt waren voor de protheses, konden ze scheuren en lekken. In de nasleep van het incident werd de behoefte aan een registratiesysteem duidelijk om implantaten te kunnen traceren. Sommige patiëntes wisten immers zelf niet of ze PIP-implantaten hadden, en hun artsen konden het evenmin achterhalen. In 2014 gaf de Belgische Privacycommissie groen licht voor zo’n centraal traceringsregister. Vier jaar later is het er nog altijd niet. ‘Er is inderdaad een vertraging, hoofdzakelijk vanwege IT-problemen’, klinkt het bij het kabinet van minister van Volksgezondheid Maggie De Block (Open VLD). ‘Elk ziekenhuis heeft zijn eigen systeem. De gegevens uit al die registers moeten samengebracht worden in één register. De eerste technische tests brachten nog een aantal kinderziektes aan het licht. Die worden nu verholpen. We willen dit zo snel mogelijk rond krijgen.’

De implantatencommissie draait al jaren vierkant
De Evaluatiecommissie voor de medische hulpmiddelen adviseert minister De Block over de maatregelen die getroffen moeten worden naar aanleiding van incidentmeldingen met implantaten. Audits door het interne auditcomité van het FAGG maken echter brandhout van de werking van die commissie. Knack kreeg de documenten uit 2015 en 2017 in handen via de Wet op de openbaarheid van bestuur. ‘Het dringend terugtrekken van een medisch hulpmiddel, waarbij incidenten ernstig kunnen zijn voor de volksgezondheid, kan vertraging oplopen door de huidige situatie’, klinkt het. ‘De functionering van de commissie moet absoluut verbeterd worden.’ Het FAGG reageert dat in tussentijd zijn eigen experts de minister hebben geadviseerd over te nemen maatregelen bij incidenten. ‘We hebben ook een voorstel uitgewerkt om de bestaande Evaluatiecommissie te vervangen door een netwerk van externe experts dat permanent in verbinding staat met experts van het FAGG. De wetteksten daarvoor zijn in voorbereiding.’
Fout opgemerkt of meer nieuws? Meld het hier